 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
在2 L容积不变的容器中,发生N2(g)+3H2(g) 2NH3(g)的反应。现通入4 mol H2和4 mol N2,10 s 内用H2表示的反应速率为0.12 mol·L-1·s-1,则10 s时容器中N2的物质的量是()
A、1.6 mol
B、2.8 mol
C、3.2 mol
D、3.6 mol

 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
A、1.6 mol
B、2.8 mol
C、3.2 mol
D、3.6 mol

 更多“在2 L容积不变的容器中,发生N2(g)+3H2…”相关的问题
更多“在2 L容积不变的容器中,发生N2(g)+3H2…”相关的问题
A、x+y<z
B、平衡向正反应方向移动
C、的转化率增大
D、的体积分数下降
A、1.2mol/(L·min)
B、1.8mol/(L·min)
C、0.6mol/(L·min)
D、0.4mol/(L·min)
能源是人类共同关注的重要问题。页岩气是从页岩层中开采出来的一种非常重要的天然气资源,页岩气的主要成分是甲烷,是公认的洁净能源。
(1)页岩气不仅能用作燃料,还可用于生产合成气(CO和H2)。CH4与H2O(g)通入聚焦太阳能反应器,发生反应CH4(g)+H2O(g)=CO(g)+3H2(g)△H1
已知:①CH4、H2、CO的燃烧热(△H)分别为-a()kJ•mol-1、-bkJ•mol-1、-ckJ•mol-1;②H2O(l)=H2O(g);△H=+dkJ•mol-1
则△H1=()(用含字母a、b、c、d的代数式表示)kJ•mol-1。
(2)用合成气生成甲醇的反应为:CO(g)+2H2(g)⇌CH3OH(g)△H2,在10L恒容密闭容器中按物质的量之比1∶2充入CO和H2,测得CO的平衡转化率与温度和压强的关系如下图所示,200℃时n(H2)随时间的变化如下表所示: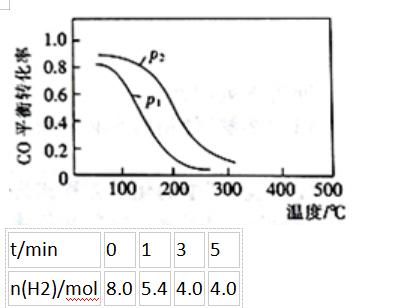 ①△H2()(填“>”“<”或“=”)0。
①△H2()(填“>”“<”或“=”)0。
②下列说法正确的是()(填标号)。
a.温度越高,该反应的平衡常数越大
b.达平衡后再充入稀有气体,CO的转化率提高
c.容器内气体压强不再变化时,反应达到最大限度
d.图中压强p1<p2
③0〜3min内用CH3OH表示的反应速率v(CH3OH)=()mol•L-1·min-1。(计算结果保留两位有效数字)
④200℃时,该反应的平衡常数K=()。向上述200℃达到平衡的恒容密闭容器中再加入2molCO、2molH2、2molCH3OH,保持温度不变,则化学平衡()(填“正向”、“逆向”或“不”)移动。
(3)甲烷、氧气和KOH溶液可组成燃料电池。标准状况下通入5.6L甲烷,测得电路中转移1.2mol电子,则甲烷的利用率为()。
A、起始时刻和达到平衡后容器中的压强比为1∶1
B、物质AB的转化率之比一定是1∶2
C、若起始放入3molA和3molB则达到平衡时生成3amolC
D、当v正(A)=v逆(B)时,可断定反应达到平衡
A、若缩小容器的体积,则容器中气体的颜色先变深后又变浅,且比原平衡颜色深
B、若压强不变,向容器中再加入一定量的N2O4,再次达到平衡时各种物质的百分含量不变
C、若体积不变,向容器中再加入一定量的N2O4,相对于原平衡,平衡向正反应方向移动,再次平衡时N2O4的转化率将升高
D、若体积不变,升高温度,再次平衡时体系颜色加深
A、x+y
B、平衡向正反应方向移动
C、的体积分数降低
D、B的浓度增大
A、保持温度和压强不变,充入氮气
B、保持温度和容积不变,充入氮气
C、温度、容积不变,通入SO2气体
D、保持温度和容积不变,充入少量H2S气体
A、v(H2)=0.1mol·(L·min)-1
B、v(N2)=0.1mol·(L·min)-1
C、v(N2)=0.2mol·(L·min)-1
D、v(NH3)=0.3mol·(L·min)-1
烟气的脱硫(除SO2)技术和脱硝(除NOx)技术都是环境科学研究的热点。
问题一、选择性催化复原法的脱硝原理为:

①上述反应中每转移3mol电子,生成标准状况下N2的体积为()L。
②已知:2H2(g)+O2(g)=2H2O(g)ΔH=-483.6kJ•mol-1
N2(g)+3H2(g)=2NH3(g)ΔH=-92.4kJ•mol-1
N2(g)+O2(g)=2NO(g)ΔH=-180.5kJ•mol-1
则反应6NO(g)+4NH3(g)=5N2(g)+6H2O(g)的ΔH=()。
问题二、目前,科学家正在研究一种以乙烯作为复原剂的脱硝(NO)原理,其脱硝机理示意图如以下图1,脱硝率与温度、负载率(分子筛中催化剂的质量分数)的关系如图2所示。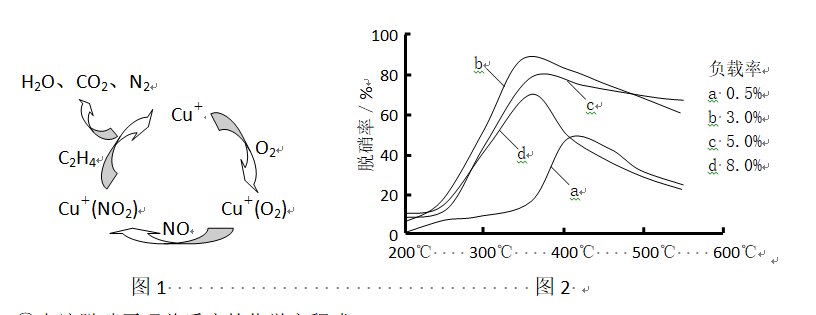
①出该脱硝原理总反应的化学方程式:()。
②为到达最正确脱硝效果,应采取的条件是()。
A、1:3
B、1:2
C、4:5
D、2:3