 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
在一定温度下,向一个2 L的真空密闭容器中(预先装入催化剂)通入1 mol N2和3 mol H2,经过一段时间后,测得容器内压强是起始时的0.9倍。在此时间段内H2的平均反应速率为0.1 mol·L-1·min-1,则经过时间为()
A、2 min
B、3 min
C、4 min
D、5 min

 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
A、2 min
B、3 min
C、4 min
D、5 min

 更多“在一定温度下,向一个2 L的真空密闭容器中(预先…”相关的问题
更多“在一定温度下,向一个2 L的真空密闭容器中(预先…”相关的问题
A、SO2和SO3的物质的量一定相等
B、NO2和SO3的物质的量一定相等
C、反应混合物的总物质的量一定等于反应开始时NO2和SO2的总物质的量
D、SO2、NO2、NO、SO3的物质的量一定相等
A、若缩小容器的体积,则容器中气体的颜色先变深后又变浅,且比原平衡颜色深
B、若压强不变,向容器中再加入一定量的N2O4,再次达到平衡时各种物质的百分含量不变
C、若体积不变,向容器中再加入一定量的N2O4,相对于原平衡,平衡向正反应方向移动,再次平衡时N2O4的转化率将升高
D、若体积不变,升高温度,再次平衡时体系颜色加深
A、混合气体的压强
B、混合气体的密度
C、的物质的量浓度
D、气体的总物质的量
能源是人类共同关注的重要问题。页岩气是从页岩层中开采出来的一种非常重要的天然气资源,页岩气的主要成分是甲烷,是公认的洁净能源。
(1)页岩气不仅能用作燃料,还可用于生产合成气(CO和H2)。CH4与H2O(g)通入聚焦太阳能反应器,发生反应CH4(g)+H2O(g)=CO(g)+3H2(g)△H1
已知:①CH4、H2、CO的燃烧热(△H)分别为-a()kJ•mol-1、-bkJ•mol-1、-ckJ•mol-1;②H2O(l)=H2O(g);△H=+dkJ•mol-1
则△H1=()(用含字母a、b、c、d的代数式表示)kJ•mol-1。
(2)用合成气生成甲醇的反应为:CO(g)+2H2(g)⇌CH3OH(g)△H2,在10L恒容密闭容器中按物质的量之比1∶2充入CO和H2,测得CO的平衡转化率与温度和压强的关系如下图所示,200℃时n(H2)随时间的变化如下表所示: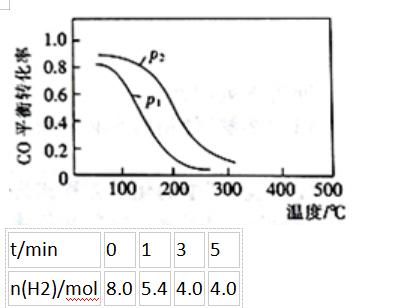 ①△H2()(填“>”“<”或“=”)0。
①△H2()(填“>”“<”或“=”)0。
②下列说法正确的是()(填标号)。
a.温度越高,该反应的平衡常数越大
b.达平衡后再充入稀有气体,CO的转化率提高
c.容器内气体压强不再变化时,反应达到最大限度
d.图中压强p1<p2
③0〜3min内用CH3OH表示的反应速率v(CH3OH)=()mol•L-1·min-1。(计算结果保留两位有效数字)
④200℃时,该反应的平衡常数K=()。向上述200℃达到平衡的恒容密闭容器中再加入2molCO、2molH2、2molCH3OH,保持温度不变,则化学平衡()(填“正向”、“逆向”或“不”)移动。
(3)甲烷、氧气和KOH溶液可组成燃料电池。标准状况下通入5.6L甲烷,测得电路中转移1.2mol电子,则甲烷的利用率为()。
A、参加反应的P与Q的质量比为3:2
B、x的取值范围:0≤x≤30
C、当y≤24时,该反应一定是化合反应
D、x+y=65
A、生成1molCO的同时生成1molH2
B、容器中物质的总质量不发生变化
C、n(H2O):n(H2)=1 :1
D、v逆(H2O)=v正(CO)
氮化镓(GaN)是第三代半导体材料,具有热导率高、化学稳定性好等性质,在光电领域和高频微波器件应用等方面有广阔的前景。
(1)传统的氮化镓制各方法是采用GaC13与NH3在一定条件下反应。NH3的电子式为()。
(2)Johnson等人首次在1100℃下用液态镓与氨气制得氮化镓固体,该可逆反应每生成1molH2放出10.3kJ热量。其热化学方程式为()。
(3)在恒容密闭容器中,加入一定量的液态镓与氨气发生上述反应,测得反应平衡体系中NH3的体积分数与压强(p)、温度(T)的关系如图所示。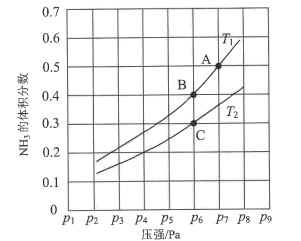 ①下列说法正确的是()(填标号)。
①下列说法正确的是()(填标号)。
a.温度:T1>T2
b.当百分含量ω(NH3)=ω(H2)时,说明该反应处于化学平衡状态
c.A点的反应速率小于C点的反应速率
d.温度恒定为T2,达平衡后再充入氦气(氦气不参与反应),NH3的转化率不变
②既能提高反应速率又能使平衡正向移动的措施有()(写出一条即可)。
③气体分压(p分)=气体总压(p总)×体积分数,用平衡分压代替物质的量浓度也可以表示平衡常数(记作Kp)。在T2时,用含p6的计算式表示C点的()。
(4)如图可表示氮化镓与铜组装成的人工光合系统的工作原理。H+向()(填“左”或“右”)池移动;铜电极上发生反应的电极反应式为()。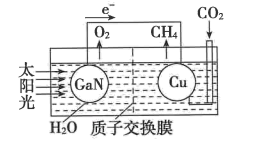
A、1.2mol/(L·min)
B、1.8mol/(L·min)
C、0.6mol/(L·min)
D、0.4mol/(L·min)
进料以某种方式被加热至部分汽化,经过减压设施,引入一个容器空间内。在一定的温度和压力下,气液两相迅速分离,得到相应的气液两相产物,称为()。
A、加热
B、闪蒸
C、渐次汽化
D、精馏