 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)


用括号中的试剂除去下列各组中的少量杂质,最恰当的一组是()。
A、苯中的苯酚(溴水)
B、乙醇中的水(新制的氧化钙)
C、苯酚中的乙酸(饱和碳酸钠溶液)
D、乙酸乙酯中的乙酸(乙醇)

 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)


A、苯中的苯酚(溴水)
B、乙醇中的水(新制的氧化钙)
C、苯酚中的乙酸(饱和碳酸钠溶液)
D、乙酸乙酯中的乙酸(乙醇)

 更多“用括号中的试剂除去下列各组中的少量杂质,最恰当的…”相关的问题
更多“用括号中的试剂除去下列各组中的少量杂质,最恰当的…”相关的问题
A、二氧化碳中混有一氧化碳(灼热氧化铜)
B、硝酸铜溶液中混有的硝酸银(铜粉)
C、氢气中混有的水蒸气(浓硫酸)
D、二氧化碳中混有的氯化氢气体(氢氧化钠溶液)
A、一氧化碳中混有少量二氧化碳,通过足量的澄清石灰水
B、碳粉中混有少量氧化铜粉末,加入足量的稀盐酸
C、碳酸钙中混有少量氯化钠,加入足量的水,过滤洗涤干燥
D、稀盐酸中混有少量稀硫酸,加入过量的硝酸钡溶液
A、选项实验目的所用试剂或方法
B、A除去CO中的CO2通过装澄清石灰水的洗气瓶
C、B区分水和汽油高锰酸钾粉末
D、C除去NH3中的水蒸气通过装浓硫酸的洗气瓶
E、D区分生石灰和熟石灰粉末向少量样品中加大量水比较其溶解的程度
A、除去NaHCO3溶液中混有的Na2CO3,可以通入适量的二氧化碳
B、除去BaCl2溶液中的少量HCl,可以加入过量的BaCO3,然后过滤
C、某溶液中滴加稀盐酸,有气泡生成,将气体通入澄清石灰水变浑浊,该溶液中一定是碳酸根离子
D、在久置的某氢氧化钠溶液中滴加酚酞,溶液变红;再加入过量的氯化钡溶液,有白色沉淀生成,同时溶液变为无色。说明该氢氧化钠溶液已经部分变质
工业上以锂辉石(Li2O·A12O3·4SiO2,含少量Ca、Mg元素)为原料生产碳酸锂。其部分工艺流程如下: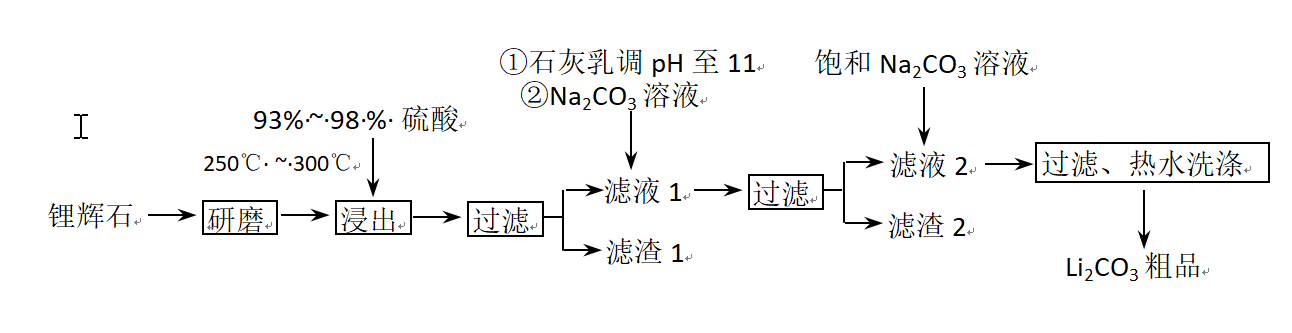 已知:①
已知:①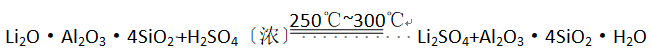 ②某些物质的溶解度(S)如下表所示
②某些物质的溶解度(S)如下表所示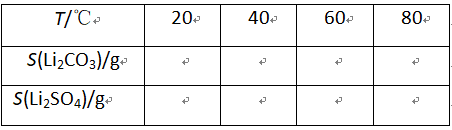
问题一、从滤渣1中别离出Al2O3的部分流程如以下图所示,括号表示加入的试剂,方框表示所得到的物质。则步骤Ⅱ中反应的离子方程式是()。
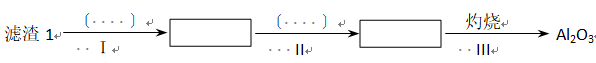
问题二、已知滤渣2的主要成分有Mg(OH)2和CaCO3向滤液1中加入石灰乳的作用是(运用化学平衡原理简述)()
问题三、向滤液2中加入饱和Na2CO3溶液,过滤后,用“热水洗涤”的原因是()
问题四、工业上,将Li2CO3粗品制备成高纯Li2CO3的部分工艺如下()
a.将Li2CO3溶于盐酸作电解槽的阳极液,LiOH溶液作阴极液,两者用离子选择透过膜隔开,用惰性电极电解
b.电解后向LiOH溶液中加入过量NH4HCO3溶液,过滤、烘干得高纯Li2CO3
①a中,阳极的电极反应式是()。
②b中,生成Li2CO3反应的化学方程式是()。
我国是世界产镁大国,金属镁的产量居世界前列。一种由白云石(主要成分为CaO▪MgO,含少量SiO2、A12O3、Fe2O3等杂质)冶炼金属镁的工艺流程如图: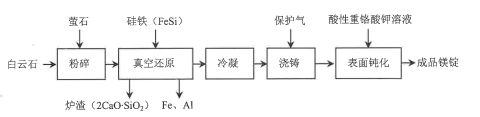 已知:萤石的主要成分是CaF2,用于降低真空还原反应的活化能。
已知:萤石的主要成分是CaF2,用于降低真空还原反应的活化能。
回答下列问题:
(1)①粉碎的主要目的()。
②萤石在真空还原反应中的作用是()(填标号)。
A.氧化剂B.还原剂C.催化剂
(2)Mg2+、Ca2+、Fe3+、Fe2+、A13+五种离子的氧化性由强到弱的顺序为Fe3+>Fe2+>()(用离子符号表示)。
(3)结合流程以及如图温度对MgO还原率的影响关系,真空还原反应温度的最佳选择为();高温真空还原时,CaO、MgO和FeSi反应生成单质镁的化学方程式为()。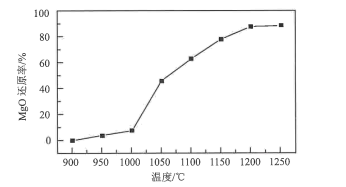 (4)液态镁浇铸成镁锭时,通入的保护气不可选用N2或CO2,其原因是()。
(4)液态镁浇铸成镁锭时,通入的保护气不可选用N2或CO2,其原因是()。
(5)镁锭冷却后,用酸性K2Cr2O7溶液进行表面钝化形成致密的氧化物保护膜,还原产物为Cr3+。该反应的离子方程式为()。
(6)为测定镁锭的纯度,称取a()g除去氧化膜的成品镁锭样品溶于足量稀硫酸中,配成250mL溶液。取25mL该溶液,用0.1000mol/L的EDTA标准溶液进行滴定(杂质不干扰滴定),三次滴定平均消耗EDTA标准溶液V()mL(己知Mg2+与EDTA反应的化学计量数之比为1:1)。该样品的纯度为()%。